News

***Bundesverwaltungsgericht: Keine Bio-Kennzeichnung bei Lebensmitteln mit zugesetzten Vitaminen und Mineralstoffen*** - 05.09.2025
Das Bundesverwaltungsgericht in Leipzig hat gestern ein Grundsatzurteil gefällt: Werden einem Produkt aus biologisch erzeugten Fruchtsäften und Kräuterauszügen nicht-pflanzliche Vitamine oder Mineralstoffe zugesetzt, darf es nicht mehr als Bioprodukt vermarktet werden. Weder das EU-Bio-Logo noch das nationale Bio-Siegel dürfen in solchen Fällen verwendet werden. Auch die Zutatenliste darf keine Hinweise auf die biologische Herkunft einzelner Bestandteile enthalten.Die Richter betonten, dass nach der geltenden EU-Öko-Verordnung ein Zusatz von Vitaminen und Mineralstoffen nur zulässig ist, wenn dies gesetzlich vorgeschrieben ist. Das war hier nicht der Fall. Damit bestätigte das Gericht die Bescheide der Behörden sowie die Entscheidungen der Vorinstanzen.
Besondere Bedeutung hat das Urteil auch für den internationalen Handel: Selbst Produkte aus den USA, die dort nach nationalem Recht als „organic“ gekennzeichnet sind, dürfen in der EU nicht das EU-Bio-Logo tragen, wenn sie Mineralstoffe oder Vitamine nicht-pflanzlichen Ursprungs enthalten. Der Europäische Gerichtshof hatte dies bereits in einem Vorabentscheidungsverfahren klargestellt. Das Bundesverwaltungsgericht folgte nun dieser Linie und schuf damit Rechtssicherheit.
BVerwG 3 C 13.24 - Urteil vom 04. September 2025
Vorinstanzen:
VG München, VG M 18 K 14.5345 - Urteil vom 17. Februar 2016 -
VGH München, VGH 20 BV 16.1456 - Urteil vom 29. Juli 2021 -
Hier geht's zur PM: https://www.bverwg.de/pm/2025/64

***Gutes Fett – schlechte Daten? Olivenöl wird von der EFSA negativ bewertet – zwei Health Claims abgelehnt.*** - 14.08.2025
Zwei aktuelle Entscheidungen der EFSA werfen ein Schlaglicht auf die Herausforderungen bei der wissenschaftlichen Bewertung von Health Claims über Lebensmittel – konkret bei Polyphenolen in nativem Olivenöl extra.???? Abgelehnt wurde der Claim, dass Olivenöl-Polyphenole zur Erhaltung eines normalen HDL-Cholesterinspiegels beitragen. Zwar zeigte eine Interventionsstudie bei erwachsenen Männern einen dosisabhängigen Anstieg des HDL-C-Wertes nach dem täglichen Verzehr von Olivenölpolyphenolen über einen Zeitraum von drei Wochen. Diese Ergebnisse werden jedoch durch andere Studien nicht gestützt und konnten in anderen Bevölkerungsgruppen nicht bestätigt werden. Die EFSA schlussfolgerte daher: „Es kann keine Ursache-Wirkungs-Beziehung abgeleitet werden.“ https://efsa.onlinelibrary.wiley.com/doi/10.2903/j.efsa.2025.9372
Auch der vorgeschlagene Claim, dass natürliche Polyphenole in Olivenöl den LDL-Cholesterinspiegel und den systolischen Blutdruck senken und somit das Risiko für Herz-Kreislauf-Erkrankungen mindern könnten, wurde nicht bestätigt. Die EFSA betont: „Die verfügbaren Daten reichen nicht aus, um einen kausalen Zusammenhang herzustellen.“ Bei der Gewichtung der Belege kam das Gremium zu dem Schluss, dass eine Interventionsstudie am Menschen mit Hypercholesterinämie zwar eine Senkung des LDL-C-Wertes nach täglichem Verzehr von Olivenöl-Polyphenolen über einen Zeitraum von drei Wochen ergab, diese Ergebnisse jedoch durch keine anderen Studien gestützt werden. Außerdem liegen laut dem Gremium keine Belege für die Nachhaltigkeit der Wirkung über längere Zeiträume (z. B. ≥ 8 Wochen) oder für einen plausiblen Wirkmechanismus vor.
https://efsa.onlinelibrary.wiley.com/doi/10.2903/j.efsa.2025.9470
✅ Ein Health Claim bleibt jedoch bestehen:
„Olivenöl-Polyphenole tragen dazu bei, die Blutfette vor oxidativem Stress zu schützen.“ Dieser Claim basiert auf gut durchgeführten klinischen Studien mit dosisabhängigen Effekten. Voraussetzung ist, dass das Öl mindestens 5 mg Hydroxytyrosol und Derivate (z. B. Oleuropein-Komplex und Tyrosol) pro 20 g enthält – ein Wert, den viele im Handel erhältliche Standard-Olivenöle nicht erreichen. https://efsa.onlinelibrary.wiley.com/doi/10.2903/j.efsa.2011.2033
???? Was heißt das für Hersteller, Produktentwickler und Vermarkter?
➡️ Nur wer gezielt standardisierte Produkte einsetzt und analytisch absichert, kann rechtssicher mit zugelassenen Claims arbeiten.
➡️ Gleichzeitig zeigt sich: Die Forschung zu Olivenöl ist dynamisch – aber es braucht robuste, langfristige Studien, um neue Health Claims zu etablieren.
Bild: Tung Lam, Pixabay

***Abfuhr für die Werbung mit „Probiotika“ – Ombudsmann stärkt EU-Kommission den Rücken*** - 03.04.2025
Bereits seit 2007 legt der rechtsunverbindliche Leitfaden [Guidance on the Implementation of Regulation N° 1924/2006 on Nutrition and Health Claims made on food] die Sichtweise der EU-Kommission zu einzelnen Aspekten der Health-Claims-Verordnung dar. Demnach ist eine Angabe wie „enthält Probiotika/Präbiotika“ als Health Claim einzustufen ist, da ein gesundheitlicher Nutzen impliziert wird. Da diese bisher nicht zugelassen sind, sind diese „impliziten Health Claims“ (oder ähnliche Angaben wie "probiotisch" oder "präbiotisch") – zumindest aus Sicht der EU-Kommission – verboten.Die International Probiotics Association (IPA) hatte kürzlich gegen diese Begriffsauslegung eine Beschwerde eingelegt und eine harmonisierte Verwendung der Angabe „Probiotika“ in der EU gefordert, da eine wachsende Zahl von EU-Mitgliedstaaten die Verwendung dieser Angabe unterschiedlich handhabt. Beispielsweise wird der Begriff „Probiotika“ in der Tschechischen Republik als nährwertbezogene Angabe eingestuft, während er in Italien nicht der HCVO unterliegt. In den Niederlanden kann „Probiotika“ unter bestimmten Bedingungen als Kategorienbezeichnung für NEM verwendet werden. Die IPA spricht sich dafür aus, „Probiotika“ als neutralen Deskriptor oder nährwertbezogene Angabe und nicht als gesundheitsbezogene Angabe einzuordnen. Die bisherige restriktive Auslegung der EU-Kommission schränkt aus Sicht der IPA den Zugang der Verbraucher zu Informationen über Probiotika ein.
Die Europäische Ombudsstelle wies die IPA-Beschwerde zurück und entschied, dass die Position der EU-Kommission angemessen ist, da die WHO-Definition bereits einen Gesundheitsbezug enthält („lebende Mikroorganismen, die […] einen gesundheitlichen Nutzen haben“).
Der Leitfaden der Kommission sieht auch Angaben wie „enthält Antioxidantien“ als bisher unzulässige implizite Health Claims an. Damit soll eine antioxidative Wirkung als Funktion ausgedrückt werden. Ebenfalls als Health Claims einzustufen sind Angaben, die sich in der Beschreibung eines Nährstoffs oder einer Substanz auf eine Funktionsangabe (z.B. als Adjektiv zur Substanz) beziehen, wie z.B. „mit präbiotischen Ballaststoffen“.
Wie aber sind Angaben zu beurteilen wie „mit Enzymen“ (z.B. Bromelain und Papain: werden mit Stoffwechselvorteilen assoziiert), „mit Elektrolyten“ (werden mit Hydration, Muskelkontraktion und Säure-Basen-Haushalt assoziiert) oder „mit Vitalstoffen“ (werden mit Vitalität assoziiert)? Wo wird bereits die Grenze zu impliziten Health Claims überschritten? Wie sehen Sie das? Diskutieren Sie mit!
Link zum Leitfaden der EU-Kommission: GUIDANCE ON THE IMPLEMENTATION OF REGULATION N° 1924/2006 ON NUTRITION AND HEALTH CLAIMS MADE ON FOODS CONCLUSIONS OF THE STANDING COMMITTEE ON THE FOOD CHAIN AND ANIMAL HEALTH https://www.bvl.bund.de/SharedDocs/Downloads/01_Lebensmittel/healthclaims/
guidance_claim.pdf;jsessionid=B811F4278DA5C8B01CA214470B423D07.internet992?__blob=publicationFile&v=5
Link zur Entscheidung des Europäischen Ombudsmann: https://www.ombudsman.europa.eu/en/decision/en/197581
Pic: Hadassa Loth de Oliveira

***Rotschimmelreis: "Todesstoß" für die Verwendung von Monacolin K?*** - 03.04.2025
Die EFSA hat ihre Bewertung des cholesterinsenkenden Stoffes Monacolin K aus Rotschimmelreis gemäß dem Verfahren nach Artikel 8 der Verordnung (EG) Nr. 1925/2006 aktualisiert.Das Ergebnis: Nach neueren Daten können bereits Dosen von weniger als 3 mg Monacolin K pro Tag zu Muskelschäden (Rhabdomyolyse) und Leberproblemen führen. Noch brisanter: Die EFSA sieht überhaupt keine sichere Aufnahmemenge, d.h. es konnte keine gesundheitlich unbedenkliche Dosis ermittelt werden. Aufgrund dieser Schlussfolgerungen ist es sehr wahrscheinlich, dass die Europäische Kommission Monacolin K aus Rotschimmelreis als verbotenen Stoff in den Anhang III der Verordnung (EG) Nr. 1925/2006 aufnehmen wird. Damit wäre auch die Verwendung von Monacolin K (ist identisch mit dem cholesterinsenkenden Arzneistoff Lovastatin) in Nahrungsergänzungsmitteln in der EU VERBOTEN.
Gemäß der Verordnung (EU) 2024/204 wurde bereits im Jahr 2024 die Angabe zu 10 mg Monacolin K aus Rotschimmelreis zur "Aufrechterhaltung eines normalen LDL-Cholesterinspiegels im Blut" aus der Liste der zugelassenen gesundheitsbezogenen Angaben (im Anhang der Verordnung (EU) Nr. 432/2012) gestrichen. Hersteller und Vertreiber sind gut beraten, die aktuellen Entwicklungen im Auge zu behalten, um mit entsprechenden Rezeptur- und Produktänderungen reagieren zu können.
Hier die EFSA-Stellungnahme: https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2025.9276
pic: FotoosVanRobin - Flickr: Red yeast rice
***Kreatin und kognitive Gesundheit: EFSA lehnt Health Claim ab!*** - 03.04.2025
Dass die EFSA einen Health Claim als "nicht wissenschaftlich gesichert" zurückweist, ist nichts Neues. Dies bestätigt auch die jüngste Entscheidung der EU-Behörde, einen Health Claim für Kreatin und die Verbesserung kognitiver Funktionen abzulehnen. Bei der Gewichtung der Evidenz resümierte das zuständige NDA-Panel, dass die akute Wirkung von Kreatin auf das Arbeitsgedächtnis, die in zwei Studien bei 20 g/Tag über 5-7 Tage beobachtet wurde, bei niedrigeren Dosen (2,2-14 g/Tag) oder bei kontinuierlicher Einnahme (5 g/Tag über 6 Wochen nach einer 5-tägigen Ladephase) nicht nachgewiesen werden konnte. Darüber hinaus war die positive Wirkung auf die Reaktionshemmung bei 20 g/Tag über 7 Tage ein isoliertes Ergebnis von 10 Interventionsstudien an gesunden Personen, bei denen keine Auswirkungen auf andere kognitive Bereiche beobachtet wurden. Die EFSA kam außerdem zu dem Schluss, dass die drei Interventionsstudien, die an kranken Menschen durchgeführt wurden, keine Wirkung einer Kreatinsupplementierung auf die Kognition belegen und dass die verfügbaren Belege für einen Mechanismus, durch den Kreatin die behauptete Wirkung entfalten könnte, nicht ausreichend sind.Diese Entscheidung zeigt einmal mehr, wie streng die Anforderungen an den wissenschaftlichen Nachweis gesundheitsbezogener Angaben sind. Für Lebensmittelunternehmen ist es ein klares Signal, dass auch bei etablierten Stoffen wie Kreatin qualitativ hochwertige und spezifische Forschung notwendig ist, um regulatorische Hürden zu überwinden.
Was bedeutet dies für die Zukunft von gesundheitsbezogenen Angaben und die wissenschaftliche Forschung zu Lebensmittelinhaltsstoffen? Diskutieren Sie mit!
Stellungnahme der EFSA: https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2024.9100
Grafik: Boghog2
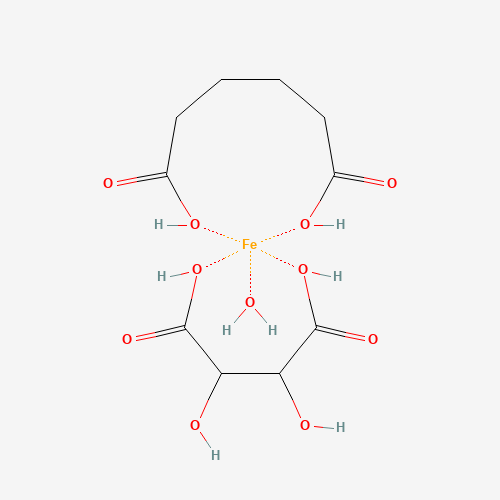
***Neuer Standard für Eisen in Nahrungsergänzungsmitteln?*** - 25.02.2024
Des Öfteren hört man, dass Eisenhydroxid-Adipat-Tartrat (Iron Hydroxyde Adipate Tartrate = IHAT) der "neue Standard" für Eisen in Nahrungsergänzungsmitteln sein soll. Was ist da dran?Here some facts:
* IHAT ist eine neuartige Nahrungsquelle für Eisen. Es wird aus einer Lösung hergestellt, die Eisen-(III)-Chlorid, Adipinsäure und L-(+)-Weinsäure enthält.
* Es soll die Eigenschaften und die Absorption von Ferritin, dem natürlichen Eisenspeicher in Pflanzen und Tieren, nachahmen.
* IHAT wurde am 28.8.2022 als Novel Food für die Verwendung in NEM zugelassen für Erwachsene ≤ 100 mg/Tag (≤ 30 mg Fe/Tag) und für Kinder/ Jugendliche unter 18 Jahren ≤ 50 mg/Tag (≤ 14 mg Fe/Tag).
* Die Bezeichnung in der Kennzeichnung des NEM muss lauten: „Eisenhydroxid-Adipat-Tartrat (Nano)“.
* Der Antragssteller und Novel Food-Zulassungsinhaber ist Nemysis Limited. Dieser verfügt bis zum 28.08.2027 über Datenschutz und währenddessen, darf IHAT in der EU nur von diesem in den Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für IHAT ohne Bezugnahme auf die wissenschaftlichen Daten oder er hat die Zustimmung von Nemysis Limited erhalten.
* Die vorgelegten Studien zur Absorption, Verteilung, zum Stoffwechsel und zur Ausscheidung (ADME) sowie zur Bioverfügbarkeit deuten darauf hin, dass Eisen aus IHAT, sobald es in die Epithelzellen des Darms aufgenommen wurde, den gleichen Regulations- und Absorptionsmechanismen unterliegt wie andere Eisenformen (also kein wirklicher Vorteil (aber auch kein Nachteil) gegenüber den bisher verwendeten Eisenverbindungen in NEM).
* Laut EFSA zeigen Ergebnisse aus Humanstudien eine Bioverfügbarkeit von Eisen aus IHAT von ca. 37 bis 76 % im Vergleich zur Eisenabsorption aus Eisensulfat (FeSO4). Eisen aus IHAT wird also in geringerem Maße resorbiert als Eisen aus Eisensulfat.
* Insgesamt schlussfolgern die EFSA und die EU-Kommission, dass IHAT eine sichere und bioverfügbare Eisenquelle darstellt. Ob es sich aber als neuer Standard für Eisen in NEM etablieren wird, bleibt jedoch abzuwarten.
Bildquelle: https://pubchem.ncbi.nlm.nih.gov/compound/Iron-hydroxide-adipate-tartrate#section=2D-Structure
***Nahrungsergänzungsmittel: Mit einer geraden Gurke als Phallussymbol für die Potenz werben?*** - 26.05.2023
In der Welt der Gesundheitswerbung für Lebensmittel kann sogar eine harmlose Gurke zur Hauptdarstellerin eines "erregenden" Rechtsstreits werden. So hat das Landgericht Magdeburg in einem Urteil (LG Magdeburg, Urt. v. 12.07.2022, Az. 36 O 80/21) entschieden, dass die Bezeichnung "Erectonin" für ein Nahrungsergänzungsmittel gegen die Health-Claims-Verordnung (HCVO) verstößt und somit unzulässig ist, weil insbesondere der wissenschaftliche Nachweis fehlt. Die Beklagte hatte das Produkt mit einer halbseitigen Anzeige in einer Tageszeitung beworben, in der unter anderem eine Gurke als Symbol für die männliche Potenz abgebildet war (auf dem Bild: links: krumme Gurke ohne Einnahme des Mittels – rechts: gerade Gurke nach Einnahme des Mittels). Der klagende Wettbewerbsverband forderte die Unterlassung der Werbung. Das Gericht gab dem Kläger recht und stellte fest, dass Werbeaussagen, die beinhalten, dass ein Nahrungsergänzungsmittel die sexuelle Leistungsfähigkeit/Potenz des Mannes steigert oder Erektionsstörungen mindert, als gesundheitsbezogene Angaben im Sinne des Art. 2 Abs. 2 Nr. 5 HCVO anzusehen sind.„Dies gilt zum einen für den Namen des Nahrungsergänzungsmittels „Erectonin“, das eine unmittelbare Nähe zu dem Wort „Erektion“ aufweist. Hinzu kommt, dass in dem Produktnamen der Buchstabe „o“ mit dem allgemein bekannten Symbol des männlichen Geschlechts versehen ist. Die beiden letzten Silben des Wortes, also „-tonin“, erwecken den Eindruck, es handele sich um ein Tonikum, unter dem man gemeinhin ein Stärkungsmittel versteht. Diese Bestandteile des Produktnamens verleihen ihm in seiner Gesamtheit eine gesundheitsbezogene Angabe, weil der Eindruck entsteht, das Mittel stärke die Erektionsfähigkeit des Mannes“, hieß es im Urteilstenor.
Fazit für die Praxis: Trotz des erheiternden Vergleichs von krummer und kerzengerader Gurke sind Werbeaussagen zur Manneskraft und Potenz richtigerweise als gesundheitsbezogen einzuordnen und bedürfen daher einer Zulassung, wenn Lebensmittelunternehmer sie verwenden wollen. Bisher wurden jedoch keine diesbezüglichen Angaben in das Register der zulässigen gesundheitsbezogenen Angaben aufgenommen (zulässig aber z.B.: "Selen trägt zu einer normalen Spermabildung bei" oder "Zink trägt zu einer normalen Fruchtbarkeit und einer normalen Reproduktion bei").
Warum nicht einfach ein firmeneigenes Bio-Logo kreieren und damit werben? - 15.02.2023
Aus Marketing-Sicht ist das sicherlich eine aufregende Idee. Aus regulatorischer (und insbesondere aus wettbewerbsrechtlicher) Sicht kann es problematisch sein, wie ein Urteil des OLG München zeigt (OLG München, Urteil vom 9.12.2021 – 6 U 1973/21). Das Gericht hatte entschieden, dass es irreführend ist, ein firmeneigenes Bio-Logo zu verwenden, wenn dadurch der unzutreffende Eindruck erweckt wird, es handele sich um ein Gütezeichen (Bio-Siegel), das von einem Dritten auf Grund der Einhaltung bestimmter (Qualitäts-)Kriterien vergeben wird.Vorausgegangen war ein Streit zwischen der klagenden Wettbewerbszentrale (WBZ) und dem beklagten Unternehmen, das Naturarzneien, Lebens- und Nahrungsergänzungsmittel sowie Tees produziert und vertreibt und auf der unternehmenseigenen Webseite ein selbst gestaltetes Bio-Logo für u.a. Kräuter- und Arzneitees verwendete. Wenn man bei den Darstellungen auf der Website über das Bio-Logo fuhr, erschien in einem gesonderten Feld im Wege des „Mouse-Over“-Effekts die Angabe „S… Bio Qualität“. Ebenso wurde das selbst entwickelte Logo in einer Fachzeitschrift für eine Werbung für einen Arzneitee mit Kamillenblüten genutzt.
Das beklagte Unternehmen argumentierte, dass das konkret verwendete Bio-Siegel zur Kennzeichnung der betreffenden Produkte („wie eine Art Marke“) verwendet werde und lediglich auf deren Bio-Qualität hinweise. Das Gericht kam aber zu dem Schluss, dass die angesprochenen Verkehrskreise das streitgegenständliche Bio-Logo nicht als firmeneigenes Logo verstehen, sondern als Zeichen dafür, dass ein Dritter das Produkt nach bestimmten Anforderungen geprüft hat. Dies ergibt sich laut dem Gericht u.a. aus der äußeren Gestaltung und der Größe des Logos, da dieses wie ein Siegel oder eine Auszeichnung anmutet und sich das Logo wie eine in sich abgeschlossene Einheit darstellt, die durch die drei Pflanzen im oberen Bereich den Eindruck eines kronenartigen Wappens aufweist. Zudem ist das Logo räumlich abgesetzt vom Markennamen und von der Produktbezeichnung, was wiederum den Eindruck vermittelt, dass es sich um ein unabhängiges Element handelt. Insgesamt erscheine das Logo als separates Element im Gesamtkontext der Werbung und erweckt die Assoziation, dass die Bio-Qualität durch einen Dritten bestätigt worden ist, so das OLG München.
Fazit: Die Verwendung von firmeneigenen Bio-Siegeln kann den Tatbestand der irreführenden Werbung erfüllen – insbesondere dann, wenn nicht ausreichend kenntlich gemacht wird (z.B. durch klarstellende Hinweise), dass das Logo nicht von Dritten aufgrund konkreter Vorgaben und Kontrollen vergeben wurde.
Fachkundigen Support bei der Gestaltung der Bewerbung von Lebensmitteln mit „Bio“- oder „Öko“-Aussagen bietet Dr. Jakobs Consulting

***Bio-Lebensmittel: Angabe der Öko-Kontrollstellennummer ist verpflichtend!*** - 31.01.2023
Bio-Lebensmittel: Angabe der Öko-Kontrollstellennummer ist verpflichtend!In den letzten Jahren hat der stationäre sowie der Online-Handel mit Bio-Produkten einen zunehmenden Boom erfahren. Werbung mit „Bio“ und „Öko“ sind en vogue und versprechen höhere Absätze und Gewinnmargen als konventionelle Lebensmittel. Jedoch sind Werbung und Kennzeichnung für biologisch erzeugte Lebensmittel streng reguliert. Eine stets verpflichtende Angabe ist der Code der zuständigen Öko-Kontrollstelle. Dies wurde vom Landgericht Dessau-Roßlau in einem Urteil bestätigt (siehe LG Dessau-Rosslau, Urt. v. 06.07.2022, Az. 3 O 10/22, https://www.landesrecht.sachsen-anhalt.de/bsst/document/KORE554942022).
So hat das Gericht entschieden, dass beim Angebot und Vertrieb von Bio-Lebensmitteln die Angabe der Öko-Kontrollstellennummer eine Pflichtangabe darstellt, deren Unterlassen im Online-Vertrieb wettbewerbswidrig ist. Laut dem Urteilstenor ist gegenüber den Endverbrauchern bei im Internet zum Kauf angebotenen und mit „Bio“-Angaben beworbenen vorverpackten Lebensmitteln die Codenummer der Kontrollbehörde oder Kontrollstelle anzugeben, welche für die Kontrolle des Unternehmens zuständig ist, der den letzten Erzeugungs- oder Aufbereitungsvorgang vorgenommen hat. Die Angabe muss vor Vertragsschluss erfolgen, so das Gericht.
Konkret ging es um einen Online-Shop, der unter anderem Aronia-Saft anbot, der von der Beklagten allgemein mit der Ankündigung „beste Bio-Qualität“ und „aus eigenem & biologischem Anbau“ angepriesen wurde. Dahingegen wurde auf der Webseite (mit weiterführenden Produktdetails zu dem Saft) auf die Bio-Eigenschaft nicht hingewiesen, ebenso fehlte die Angabe der Öko-Kontrollstellennummer.
Dies wurde von dem klagenden eingetragenen Wettbewerbsverein moniert. Er sah darin einen Verstoß gegen Art. 32 Abs. 1a) der VO (EU) Nr. 2018/848 (sog. Öko-VO). Die Abmahnung der Beklagten blieb erfolglos, woraufhin die Klägerin den Erlass einer einstweiligen Unterlassungsverfügung beantragte. Die beklagte Online-Händlerin argumentierte hiergegen, dass die Werbeaussagen bezüglich der Bio-Qualität sich nicht auf das streitgegenständliche Produkt bezögen, sondern ganz allgemein auf die Ursprünglichkeit und Naturbelassenheit der Früchte ihres gesamten Warensortiments hinwiesen. Das Gericht sah dies anders und gab dem Antrag der Klägerin statt. So sei der Begriff „Bio“ laut Öko-VO gesetzlich definiert und es ist bei jeder Lebensmittelwerbung, die auf die ökologische bzw. biologische Produktion Bezug nehme, gemäß Art. 30 Abs. 1 S. 1 VO (EG) bzw. Art. 32 Abs. 1 a) der Öko-VO Nr. 2018/484 eine entsprechende Kennzeichnung vorzunehmen, wozu auch die Angabe des Codes der zuständigen Öko-Kontrollstelle gehört.
Fazit: Achten Sie auf die Angabe der Öko-Kontrollstellennummer sowie auf die Kennzeichnung mit anderen verpflichtenden Angaben, wenn Sie als Lebensmittelunternehmer mit Bio- oder Öko-Angaben werben wollen.
Falls Sie fachkundigen Support bei der Gestaltung der Bewerbung von Lebensmitteln mit „Bio“- oder „Öko“-Aussagen brauchen, kommen Sie gerne auf mich zu. Als verifizierter Sachverständiger für die Kennzeichnung von Lebensmitteln und Nahrungsergänzungsmitteln unterstütze ich Sie gerne dabei!
*** Novel Foods in Nahrungsergänzungsmitteln *** - 08.03.2022
Im Dezember 2021 wurden in der EU vier neuartige Lebensmittel/Lebensmittelzutaten für die Verwendung in Nahrungsergänzungmitteln zugelassen.1. 3-Fucosyllactose (3-FL) darf laut VO (EU) 2021/2029 in NEM mit höchstens 5 g/Tag und mit besonderen Warnhinweisen (wie z.B. kein Verzehr von 3-Fucosyllactose durch Säuglinge und Kinder unter 3 Jahren, weitere Infos siehe VO) eingesetzt werden. Bis 12. Dezember 2026 zugelassen.
2. Calciumfructoborat darf laut VO (EU) 2021/2129 in NEM bis 220 mg/Tag für Verbraucher über 18 Jahre, aber nicht für Schwangere und Stillende eingesetzt werden. Bis 23. Dezember 2026 zugelassen.
3. Vitamin D2 enthaltendes, UV-behandeltes Pilzpulver darf laut VO (EU) 2021/2079 in NEM bis zu einer Höchstmenge von 15µg Vitamin D2/Tag eingesetzt werden (nicht für Kleinkinder unter 3 Jahren und Säuglinge). Bis 19. Dezember 2026 zugelassen.
4. Getrocknete Früchte von Synsepalum dulcificum dürfen laut VO (EU) 2021/1974 in NEM bis zu einer Höchstmenge von 0,7 g/Tag ausschließlich für Erwachsene (nicht für schwangere oder stillende Frauen) eingesetzt werden. Bis 5. Dezember 2026 zugelassen.
Da die Novel-Food-Anträge bei allen 4 Lebensmitteln/Zutaten mit Datenschutz versehen sind, muss während der Zeit des Datenschutzes für die Verwendung der entsprechenden Zutat/des entsprechenden Lebensmittels die Zustimmung bei dem Antragssteller eingeholt werden oder ein späterer Antragsteller erhält die Novel Food-Zulassung ohne Bezugnahme auf die geschützten Daten.
*** Verwendung von Benfotiamin ist in Nahrungsergänzungsmitteln unzulässig *** - 08.03.2022
Laut dem OVG Niedersachsen stellt das Inverkehrbringen von Nahrungsergänzungsmitteln mit Benfotiamin einen Verstoß gegen §13 Abs. 2 des LFGB dar. Streitgegenständlich war ein von einer Großhändlerin vertriebenes NEM mit der fettlöslichen Vitamin B1-Vorstufe Benfotiamin. Die zuständige Behörde hatte zuvor ein Verkehrsverbot von benfotiamin-haltigen Lebensmitteln ausgesprochen, solange Benfotiamin nicht für die Verwendung in NEM zugelassen sei (Sofortvollzug gemäß § 3 Abs. 1 NemV i.V.m. Anhang II RL 2002/46). Die Beklagte reichte Klage und einen Eilantrag auf Wiederherstellung ein, um das NEM wieder in Verkehr bringen zu dürfen. Das Verwaltungsgericht Stade lehnte dies ab, hiergegen erhob die Beklagte Beschwerde beim OVG Niedersachsen ohne Erfolg.Entscheidung und Begründung des OVG Niedersachsen:
Das Inverkehrbringen von NEM mit Benfotiamin ist ein Verstoß gegen § 13 Abs. 2 LFGB (Lebensmittel, die entgegen einer nach § 13 Abs. 1 Nr. 1 LFGB vom BMEL erlassenen Rechtsverordnung [wie NemV] verstoßen, dürfen nicht in den Verkehr gebracht werden). Gemäß § 3 Abs. 1 NemV dürfen bei der Herstellung eines NEM nur die in Anhang I RL 2002/46/ EG aufgeführten Nährstoffe in den in Anhang II aufgeführten chemischen Formen verwendet werden. Benfotiamin ist nicht im Anhang I oder II der RL 2002/46/EG aufgeführt, weshalb ein Inverkehrbringen einen Verstoß gegen § 3 Abs. 1 NemV darstellt. Auch wenn Benfotiamin eine Form des Vitamins B1 ist, sind gemäß Nr. 5 des Anh. II der RL 2002/46/EG als Vitamin-B1-Formen für den Einsatz in NEM bis dato nur zulässig:
· Thiaminhydrochlorid
· Thiaminmonophosphatchlorid
· Thiaminpyrophosphatchlorid
· Thiaminmononitrat
Ein Gutachten der EFSA (ANS Panel 2008) befasste sich mit der Ergänzung des Anh. II der 2002/46/EG um Benfotiamine und kam zu einem negativen Ergebnis: Die vorgelegten Daten reichen nicht aus, um die Sicherheit der vorgeschlagenen Verwendung und Verwendungsmengen von Benfotiamin in NEM nachzuweisen. Daher erfolgte keine Aufnahme in den Anhang II. Derzeit ist also die Verwendung von Benfotiamin als Nährstoff in NEM unzulässig.
Quelle: OVG Niedersachsen, Beschl. v. 11.11.2020 – 13 ME 400/20
*** „Haut-Claims“ auf Lebensmitteln (mit Kollagenhydrolysat/Kupfer) *** - 08.03.2022
Das OLG Stuttgart stufte Aussagen über die Verringerung von Hautfalten in der Werbung für ein Lebensmittel als spezifische gesundheitsbezogene Angaben im Sinne von Art. 10 der Health-Claims-Verordnung (HCVO) ein, wenn der optische Effekt einer Steigerung körperlicher Funktionen beschrieben wird.Sachverhalt
Die Beklagte (eine Parfümeriekette) vertrieb bei Amazon ein Produkt namens „INNERBEAUTY Collagen Youth Drink“ mit u.a. Kupfer und Kollagenhydrolysat. Der Kläger (ein Wettbewerbsverband) verlangte von der Beklagten die Unterlassung der Werbeaussagen:
1. „Wirkt von innen heraus. Der Collagen Youth Drink mit 2500 mg Kollagen und weiteren hocheffizienten Wirkstoffen verbessert das Erscheinungsbild der Haut durch… weniger Falten“
2. „Kupfer stärkt das Bindegewebe“
3. „Reduziert Falten“
„4. INNERBEAUTY wirkt gegen Hautalterung“
Der Kläger war der Auffassung, dass die Werbung gegen die HCVO verstoße, weil sie nicht zugelassene gesundheitsbezogene Angaben enthalte. Denn eine Gesundheitsangabe zu Kollagenhydrolysat habe die EFSA abgelehnt. Das LG Heilbronn hatte zuvor eine einstweilige Verfügung erlassen und der Beklagten untersagt, im geschäftlichen Verkehr mit den vier genannten Aussagen zu werben. Die Beklagte hatte dagegen Berufung eingelegt und die Aufhebung der Urteilsverfügung beantragt.
Entscheidung und Begründung des OLG Stuttgarts
Die Berufung wurde vom OLG Stuttgart zurückgewiesen, da aus Sicht des OLG Stuttgart das LG Heilbronn zutreffend festgestellt hat, dass es sich bei der angegriffenen Werbung um nicht zugelassene gesundheitsbezogene Angaben gemäß Art. 10 HCVO handelt, wenn der optische Effekt einer Steigerung körperlicher Funktionen beschrieben wird. Das Gericht nahm Bezug auf ein entsprechendes EFSA-Gutachten: Demnach stellt eine veränderte Hautelastizität und die Verringerung des Faltenvolumens, die zu einer Verbesserung der Hautgesundheit (durch Kollagenhydrolysat) führen, eine vorteilhafte physiologische Wirkung dar und ist nach der HCVO zulassungsbedürftig (EFSA Journal 2013; 11 (6):3257).
Die EFSA-Bewertung ist zwar für das OLG Stuttgart nicht bindend, aus Sicht des Gerichts aber in dieser Sache überzeugend: „Die englischsprachige Angabe „Innerbeauty“ wird vom Verbraucher in deutscher Übersetzung als „innere Schönheit“ verstanden und im konkreten Kontext dahingehend, dass die Wirkung der Schönheit von innen heraus entsteht, mithin durch eine Verbesserung der körperlichen Prozesse.“
Die Aussage „Kupfer stärkt das Bindegewebe“ ist eine unzulässige Gesundheitsangabe, weil nur der Hinweis auf einen Beitrag des Kupfers zur „Erhaltung“ von normalem Bindegewebe gemäß HCVO zugelassen ist, nicht aber der Hinweis auf eine „Stärkung“, so das OLG Stuttgart.
Quelle: OLG Stuttgart, Urt., v. 04.11.2021 – 2 U 49/21
*** Diätetisches Management von erektiler Dysfunktion *** - 08.03.2022
Vor dem OLG Brandenburg kam es zum Streit um ein Lebensmittel für besondere medizinische Zwecke (LbmZ), das von der Beklagten produziert und vertrieben wurde. Das LbmZ zur diätetischen Behandlung gestörter Gefäß- und Zellfunktionen bei erektiler Dysfunktion enthielt u.a. 3000 mg L-Arginin-Hydrochlorid, 80 mg Pinienrindenextrakt, 500 mg Betain sowie verschiedene Vitamine und Mineralstoffe. Der Kläger reichte nach erfolgloser Abmahnung wegen eines vermeintlich fehlenden Wirknachweises Klage auf Unterlassung des Inverkehrbringens des LbmZ beim LG Cottbus ein – dieser wurde stattgegeben. Die Berufung der Beklagten ließ das OLG Brandenburg zu.Entscheidung und Begründung des OLG Brandenburg
Das OLG Brandenburg wies die Klage ab, da die Beklagte die Wirksamkeit des Präparats nachgewiesen hatte.
So kann der Wirksamkeitsnachweis durch Vorlage von Studien erbracht werden, die nach allgemein anerkannten wissenschaftlichen Grundsätzen erstellt worden sind. Dabei ist es nicht erforderlich, dass die Wirksamkeit in der Fachwelt allgemein anerkannt und unumstritten ist. Vielmehr ist es ausreichend, wenn das Mittel in seiner Kombination der einzelnen Inhaltsstoffe die angegebene Wirkung erzielt. Nicht erforderlich ist es, dass alle Inhaltsstoffe des LbmZ wirksam sein müssen.
Der Wirksamkeitsnachweis setzt im Regelfall eine randomisierte, placebokontrollierte Doppelblindstudie (RCT) mit einer adäquaten statistischen Auswertung voraus, die durch Veröffentlichung in den Diskussionsprozess der Fachwelt einbezogen worden ist. Das streitgegenständliche Produkt erfüllt aus Sicht des Gerichts die notwendigen Anforderungen an ein LbmZ:
o Vertrieb in arzneimitteltypischer Darreichungsform als Kapsel
o diätetische Behandlung einer Erkrankung
o Vorlage von drei Studien (2 RCTs + 1 unkontrollierte Studie), die in ihrer Gesamtschau als aussagekräftig anzusehen sind und auf das Präparat übertragbar sind.
Quelle: OLG Brandenburg, Urt. v. 23. 4. 2019 – 6 U 43/16
*** Curcumin-Gehalt in Nahrungsergänzungsmitteln *** - 08.03.2022
Der Verwaltungsgerichtshof (VGH) Baden-Württemberg hat entschieden, dass die gesundheitsschädliche Wirkung eines Lebensmittels i.S.d. Art. 14 Abs. 2 Buchst. a) der Verordnung (EG) Nr.178/2002 nicht ohne weiteres bereits dann angenommen werden kann, wenn der ADI-Wert („acceptable daily intake“) für einen in dem Lebensmittel enthaltenen Stoff überschritten wird.Konkret ging es um ein NEM mit Curcuma in Kapselform. In einem Gutachten des Chemischen- und Veterinäruntersuchungsamt (CVUA)-Stuttgart wurde der Curcumingehalt als „zu hoch“ eingestuft. Die erlaubte Tagesdosis (ADI) für Curcumin liegt täglich bei 3 mg pro kg Körpergewicht (KG), was bei einer 70 kg schweren Person 210 mg entspricht. Die Einnahme einer Kapsel des NEM lieferte ca. 317 mg Curcumin, was bei 70 kg Körpergewicht einer Aufnahmemenge von 4,5 mg pro kg Körpergewicht ausmacht und somit den ADI-Wert (3 mg/kg KG) überschreitet. Beim Verzehr der empfohlenen Tagesdosis von drei Kapseln ist der ADI sogar um das Vierfache erhöht, so das CVUA-Stuttgart. Daher stufte die klagende Behörde das NEM als nicht zum Verzehr geeignet und nicht sicher ein (i.S.d. Art. 14 Abs. 2 a) VO (EG) Nr.178/2002). Das Landratsamt Tübingen untersagte daraufhin die Curcuma Kapseln in den Verkehr zu bringen (Sofortvollzug). Dagegen legte der Vertreiber der Curcuma -Kapseln Widerspruch und Beschwerde ein.
Das VGH Baden-Württemberg urteilte, dass wenn der ADI-Wert überschritten wird, keine Annahme einer gesundheitsschädlichen Wirkung eines Lebensmittels per se möglich ist. Ob und in welchem Ausmaß ein Gefahrenpotenzial für die menschliche Gesundheit resultiert, bedarf einer Bewertung im Einzelfall.
Die behördliche Annahme, dass das NEM wegen Überschreitung des ADI-Werts für Curcumin zum Verzehr ungeeignet ist, erscheint nicht tragfähig, so das Gericht. Eine abschließende Beurteilung, ob das NEM eine gesundheitsschädliche Wirkung entfaltet, ist für den VGH BaWü nicht möglich.
Quelle: VGH Baden-Württemberg Beschluss vom 17.9.2020, 9 S 2343/20
Unabhängig von diesem Urteil sei darauf hingewiesen, dass Piperin (als Bestandteil von NEM) die Bioverfügbarkeit von Curcumin erhöhen kann und es auch dadurch zu einer Überschreitung des ADI-Wertes für Curcumin (3 mg/kg KG/Tag) kommen kann. Siehe Stellungnahme des BfR: https://lnkd.in/gSyid9Av
*** Einstufung von Selenpräparaten durch BfArM/BVL *** - 08.03.2022
Im Dezember 2021 hat die Gemeinsame Expertenkommission zur Einstufung von Stoffen am Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) und Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) eine Stellungnahme zur produktrechtlichen Abgrenzung von selenhaltigen Nahrungsergänzungsmitteln und Arzneimitteln veröffentlicht. Während selenhaltige Arzneimittel zur Behandlung eines nachgewiesenen Selenmangels verwendet werden, der durch die Ernährung nicht behoben werden kann, sind NEM zur Ergänzung der allgemeinen Ernährung bestimmt. Nach gegenwärtigen Schätzungen soll die nahrungsbedingte Selenzufuhr bei Erwachsenen in Deutschland bei ca. 30–50 µg pro Tag liegen, so die Gemeinsame Expertenkommission. Sie schlussfolgert:„Damit liegt die geschätzte Selenzufuhr bei Erwachsenen unterhalb der Zufuhrempfehlungen der Fachgesellschaften für Ernährung Deutschlands, Österreichs und der Schweiz und der Europäischen Behörde für Lebensmittelsicherheit (EFSA) von 60–70 µg pro Tag. Allerdings kommt in Deutschland in der Regel kein klinisch relevanter Selenmangel aufgrund einer Unterversorgung über die allgemeine Ernährung vor. Die Gemeinsame Expertenkommission geht daher bei Dosierungen von bis zu 50 µg Selen pro Tag von einer ernährungsspezifischen bzw. einer physiologischen Wirkung aus, die selbst bei einer sehr geringen Selenzufuhr über die Nahrung für eine Aufrechterhaltung einer adäquaten Selenversorgung ausreichend ist. Für NEM in Dosierungen oberhalb von 50 µg Selen pro Tag erkennt die Gemeinsame Expertenkommission aus wissenschaftlicher Sicht keinen über den Ausgleich hinausgehenden ernährungsspezifischen Nutzen.“
Da aus Sicht der Gemeinsamen Expertenkommission durch die allgemeine Ernährung der von der EFSA abgeleitete UL (Tolerable Upper Intake Level) von 300 µg pro Tag überschritten und somit unter Umständen der toxikologisch relevante Bereich erreicht werden kann, kommt für hoch dosierte selenhaltige NEM eine Beurteilung als nicht sicheres und damit nicht verkehrsfähiges Lebensmittel gemäß Art. 14 der Verordnung (EG) Nr. 178/2002 in Betracht.
Siehe Stellungnahme der Gemeinsamen Expertenkommission zur Einstufung von Stoffen: https://lnkd.in/ghmhutvy
*** Lysinhaltiges Lebensmittel zum Diätmanagement bei wiederkehrenden Herpes Simplex Infektionen *** - 08.03.2022
Das Schleswig-Holsteinische OLG hatte über die Bewerbung lysinhaltiger Tabletten zu entscheiden, die von der Beklagten auf ihrer Internet-Seite als "Lebensmittel für besondere medizinische Zwecke (LMBZ) zum Diätmanagement bei wiederkehrenden Herpes Simplex Infektionen" beschrieben wurden. Der Kläger, ein Wettbewerbsverband, hielt dies für unzulässig, da mit dem LMBZ kein medizinisch bedingter Nährstoffdefizit ausgeglichen werde. So führe Herpes Simplex nicht zu einem Nährstoffdefizit. Der Kläger begehrte die Unterlassung der Werbeaussagen. Das Landgericht Kiel hatte der Klage stattgegeben, daraufhin ging die Beklagte in Berufung.Entscheidung und Begründung
Das Schleswig-Holsteinisches OLG lehnte die Berufung ab. „Ein lysinhaltiges Lebensmittel zum Diätmanagement bei wiederkehrenden Herpes Simplex Infektionen darf nicht als Lebensmittel für besondere medizinische Zwecke vertrieben werden, weil rein ernährungsphysiologisch mit Herpes-Viren infizierte Personen keinen erhöhten Lysin-Bedarf haben. Sie können die für eine ausgewogene Ernährung notwendige Menge an Lysin aus der üblichen Nahrung gewinnen. Daran ändert die Infizierung mit den Viren nichts. Eine mit Herpes infizierte Person kann aus der normalen Nahrung nicht weniger L-Lysin aufnehmen als eine nicht infizierte. Sie benötigt aufgrund der Erkrankung auch nicht mehr L-Lysin, um sich gesund zu ernähren.
Der Begriff des LbmZ ist aus Sicht des Gerichts dahin auszulegen, dass dieses dazu dienen muss, ein medizinisch bedingtes Nährstoffdefizit auszugleichen (enge Auslegung des Ernährungsbegriffs). Falls mit einem Präparat auf andere Weise (durch die Nährstoffzufuhr) Erkrankungen entgegengewirkt werden soll, dann liegt kein LbmZ vor. Am „weiten Ernährungsbegriff“ der BGH-Rechtsprechung kann somit nicht weiterhin festgehalten werden. Die enge Auslegung des Ernährungsbegriffs soll für Rechtssicherheit sorgen und durch einheitliche Rechtsanwendung einen störungsfreien Handel im Binnenmarkt ermöglichen. Eine europaweit einheitliche Rechtsprechung für die Zukunft ist nur bei einer Beschränkung des Begriffs des medizinisch bedingten Nährstoffbedarfs auf den Ausgleich eines Ernährungsmangels gewährleistet, so das Schleswig-Holsteinisches OLG.
Quelle: Schleswig-Holsteinisches OLG, Ur. v. 25.03.2021 – 6 U 6/20
FAZIT für die Praxis:
Für die Positionierung als LMBZ ist es wichtig, das Produkt entsprechend dahin zu prüfen, ob ein durch die „zu managende“ Krankheit hervorgerufenes Nährstoffdefizit durch die enthaltenen Nährstoffe behoben werden kann.
*** Health Claims: Positive Bewertungen der EFSA in 2021 *** - 08.03.2022
Die Europäische Behörde für Lebensmittelsicherheit (EFSA) hat im Jahr 2021 zwei gesundheitsbezogene Angaben gemäß Art. 13.5 Health Claims-VO positiv beurteilt – eine zu Isomaltulose und eine zu grünen Kiwis.Isomaltulose trägt zu einem normalen Energiestoffwechsel bei
Der Zuckerersatzstoff Isomaltulose ist ein reduzierendes Disaccharid, das aus einer Glukose- und einer Fruktose-Einheit besteht. Im Rahmen der wissenschaftlichen Prüfung durch die EFSA wurden eine Reihe von Humanstudien mit indirekten Kalorimetrie-Messungen oder stabilen Isotopen-Methoden vorgelegt. Diese haben gezeigt, so die EFSA, dass die postprandiale metabolische Verwertung von Isomaltulose eine Energiequelle darstellt. Damit ist ein kausaler Zusammenhang aus Sicht der Behörde gegeben.
Allerdings, so schränkt die EFSA ein, versorgen alle energiehaltigen Makronährstoffe (d. h. Kohlenhydrate, Proteine und Lipide) den Körper mit Energie. Wirkung ist daher nicht spezifisch für Isomaltulose. Jede Isomaltulose-Menge würde zu der behaupteten Wirkung beitragen, weshalb die EFSA keine Verwendungsbedingungen für diese Angabe festlegen kann. Die Zielgruppe der Aussage „Isomaltulose trägt zu einem normalen Energiestoffwechsel bei“ ist die Allgemeinbevölkerung. Bisher liegt noch keine Zulassung dieses Isomaltulose-Claims durch die EU-Kommission vor.
Verzehr von grünen Kiwis trägt zur Aufrechterhaltung einer normalen Stuhlentleerung bei
Die konsistenten Ergebnisse aus 6 Humanstudien hatten die EFSA überzeugt, dass der tägliche Verzehr von 2 bis 4 grünen Kiwifrüchten zu einer erhöhten Stuhlgangshäufigkeit führt. Aus Sicht der EFSA gibt es Hinweise auf einen plausiblen Mechanismus, durch den Kiwifrüchte eine Wirkung auf den normalen Stuhlgang ausüben könnten. So sind in Kiwis etwa 3 % Ballaststoffe enthalten. Die unlöslichen Ballaststoffbestandteile werden von Mikroorganismen im Dickdarm nicht abgebaut und sind nicht nur durch ihr Vorhandensein, sondern auch dadurch, dass sie Wasser in der Zellstruktur binden, für die Fäkalienmenge entscheidend. Die lösliche Ballaststofffraktion werden von der Mikrobiota verstoffwechselt und stimulieren dadurch mikrobielles Wachstum, was sich wiederum auf die Fäkalienmenge auswirkt. Es ist erwiesen, dass eine erhöhte Fäkalmasse eine normale Stuhlentleerung fördert. Die Behörde bestätigt insgesamt den kausalen Zusammenhang und legt fest, dass zwei große grüne Kiwifrüchte (ca. 200 g Kiwifruchtfleisch) verzehrt werden müssen, um die behauptete Wirkung zu erzielen.
Quellen:
1. Isomaltulose and normal energy‐yielding metabolism: evaluation of a health claim pursuant to Article 13(5) of Regulation (EC) No 1924/2006 (wiley.com)
https://www.efsa.europa.eu/en/efsajournal/pub/6849
2. Green kiwifruit (lat. Actinidia deliciosa var. Hayward) and maintenance of normal defecation: evaluation of a health claim pursuant to Article 13(5) of Regulation (EC) No 1924/2006 (wiley.com)
https://www.efsa.europa.eu/en/efsajournal/pub/6641
*** Lebensmittel zum Diätmanagement altersbedingter Makuladegeneration und Immundefiziten *** - 08.03.2022
Das OLG Düsseldorf hatte über ein Erzeugnis zu entscheiden, welches das Fortschreiten der altersbedingten Makuladegeneration verlangsamen sowie bei nutritiv bedingten Immundefiziten angewandt werden soll. Die Beklagte ist ein pharmazeutisches Unternehmen, das insbesondere Lebensmittel für besondere medizinische Zwecke (LMBZ) auf den Markt bringt. Nach Auffassung des Klägers (ein Wettbewerbsverein) seien die Anforderungen an ein LbmZ nicht erfüllt:1. „[Bei den genannten Krankheiten] handele es sich nicht um Krankheiten, welche zu einer eingeschränkten, behinderten oder gestörten Fähigkeit zur Aufnahme, Verdauung, Resorption, Fettstoffwechsel oder Ausscheidung gewöhnlicher Lebensmittel oder bestimmter darin enthaltener Nährstoffe oder Stoffwechselprodukte führten.“
2. „Die zweite Alternative des Art. 2 Abs. 1 Buchst. g) FSG-Verordnung („Patienten mit einem sonstigen medizinisch bedingten Nährstoffbedarf) betreffe allein Krankheiten, die zu einem besonderen Energie- und Nährstoffbedarf des Patienten [...] führten, sie betreffe aber nicht Stoffe, die der Behandlung der Krankheit selbst dienten.“
Die Unterlassungsklage beim LG Düsseldorf gegen den Vertrieb und Bewerbung des streitgegenständlichen Erzeugnisses war erfolgreich. Die Beklagte legte Berufung beim OLG Düsseldorf ein. Um die folgenden Fragen zu klären, legte das OLG Düsseldorf diese dem EuGH zur Auslegung vor:
Frage 1: „Unter welchen Umständen liegt ein sonstiger medizinischer Nährstoffbedarf nach Art. 2 Abs. 2 Buchst. g)
2. Alternative der FSG-Verordnung vor, nämlich:
setzt dies [...] voraus, dass krankheitsbedingt ein erhöhter Nährstoffbedarf besteht, der durch das Lebensmittel gedeckt werden soll, oder reicht es aus, wenn der Patient durch die Aufnahme dieses Lebensmittels allgemein aus der Aufnahme dieses Lebensmittels Nutzen zieht, weil darin enthaltene Stoffe der Störung entgegenwirken oder deren Symptome lindern?
Frage 2: Für den Fall, dass die 1. Frage im Sinne der letztgenannten Alternative zu beantworten ist: Setzen „allgemein anerkannte wissenschaftliche Daten“ i. S. v. Art. 2 Abs. 2 der Delegierten Verordnung in jedem Falle eine randomisierte, placebokontrollierte Doppelblindstudie voraus, die zwar nicht das fragliche Erzeugnis selbst betrifft, aber zumindest Ansatzpunkte für die angegebenen Wirkungen bietet?
Resümee und Ausblick
Die Antworten des EuGH werden für mehrere, derzeit anhängige Verfahren von entscheidungsrelevanter Bedeutung sein - insbesondere sind aktuell Revisionsverfahren zu dieser Rechtsfrage beim BGH anhängig. Es wird sich auch klären, ob die BGH-Rechtsprechung („MobilPlus-Kapseln“- und „Erfokol-Kapseln“) aufrechterhalten bleibt oder nicht. Der EuGH entscheidet voraussichtlich noch in diesem Jahr. Für LmbZ bleibt es also spannend!
Quelle: OLG Düsseldorf, Beschl. v. 28.06.2021 – I-20 U 178/20



